製品の特性の詳細
ジェミーナ配合錠は月経困難症治療薬として、日本で初めてレボノルゲストレル(LNG)を含有する超低用量エストロゲン・プロゲスチン(EE 0.02mg+LNG0.09mg)配合剤です。
開発の経緯
〈月経困難症〉
月経困難症治療の第一選択薬の一つであるエストロゲン・プロゲスチン(EP)配合剤を長期間安全に服用するためには、エストロゲンの低用量化やプロゲスチンの選択が重要となります。海外におけるこれまでの研究では、レボノルゲストレル(LNG)含有製剤において、血栓症リスクが相対的に低いと報告されています1-6)。一方、日本では月経困難症を適応とするLNG含有EP配合剤は販売されていませんでした。
また、EP配合剤の連続投与*は、周期投与*に比べ月経回数を減らすことにより疼痛を軽減することが期待され、月経困難症に対する有効性が高いとされています7, 8)。周期投与では、連続投与に比べ破綻出血の発生が少ないこともあり、いずれの投与方法も選択可能な薬剤が望まれていました。
このような状況を踏まえ、1剤で周期投与と連続投与、両方の用法の取得を目指し、エチニルエストラジオール(EE)0.02mg+LNG 0.09mgを含有する超低用量EP配合剤**の開発に着手しました。
本剤の周期投与と連続投与の有効性及び安全性を検証するために、1年間の国内第Ⅲ相長期投与比較試験として、プラセボ対照二重盲検試験を実施しました。その結果、本剤の月経困難症に対する有効性及び安全性が確認され、本剤は2018年7月に、「ジェミーナ配合錠」の販売名にて、効能又は効果を月経困難症として承認されました。
〈生殖補助医療における調節卵巣刺激の開始時期の調整〉
生殖補助医療(ART)では、複数の卵胞発育と早発の黄体形成ホルモン(LH)サージの抑制を目的として、治療の効率性を高めるために調節卵巣刺激(COS)が一般的に行われています。卵巣刺激の治療前周期にEP配合剤を周期投与*することで、一般的な月経周期の28日サイクルでの消退出血の月経が起きるため、治療周期の月経開始を起点としたCOSの治療開始時期の調整が可能となります。就労等の社会生活の中で、不妊治療を実施している患者にとって、適切なタイミングで治療周期の計画的な調整が可能となり、治療の受けやすさにつながることが期待されます。
「生殖補助医療における調節卵巣刺激の開始時期の調整」の適応については、一般社団法人日本生殖医学会より保険適用に向けた開発要望9)を受けたことから、公表資料の内容に基づき本剤がARTの治療前周期に投与することでARTにおける調節卵巣刺激の開始時期を調節できると考え、医薬審第104号通知「適応外使用に関わる医療用医薬品の取り扱い」に基づく公知申請を行いました。その後2022年3月に「生殖補助医療における調節卵巣刺激の開始時期の調整」の「効能又は効果」及び「用法及び用量」が追加承認されました。
* 周期投与:ホルモン含有剤の服用と休薬を、28日間を1周期として繰り返す方法
連続投与:休薬期間の間隔を周期投与よりも長く設定し、ホルモン含有剤を継続服用する方法
** 超低用量EP配合剤:EEの含有量が0.02mg

- 1)de Bastos M, et al. Cochrane Database Syst Rev. 2014;(3): CD010813.
- 2)Plu-Bureau G, et al. Best Pract Res Clin Endocrinol Metab. 2013; 27(1): 25-34.
- 3)Martínez F, et al. Eur J Contracept Reprod Health Care. 2012; 17(1): 7-29.
- 4)Lidegaard Ø, et al. Acta Obstet Gynecol Scand. 2012; 91(7): 769-778.
- 5)Maxwell WD, et al. J Womens Health( Larchmt). 2014; 23(4): 318-326.
- 6)Stegeman BH, et al. BMJ. 2013; 347: f5298.
- 7)Kwiecien M, et al. Contraception. 2003; 67(1): 9-13.
- 8)Vercellini P, et al. Fertil Steril. 2003; 80(3): 560-563.
- 9)申請資料概要:一般社団法人日本生殖医学会:要望書(レボノルゲストレル・エチニルエストラジオール配合錠)
3. 組成・性状
- 3.1 組成
| 有効成分 (1錠中) |
レボノルゲストレル | 0.09mg |
|---|---|---|
| エチニルエストラジオール(日局) | 0.02mg | |
| 添加剤 | 無水乳糖、乳糖水和物、部分アルファー化デンプン、ステアリン酸マグネシウム、ヒプロメロース、マクロゴール400、酸化チタン、タルク、カルナウバロウ | |
- 3.2 製剤の性状
| 色・剤形 | 白色のフィルムコーティング錠 | |
|---|---|---|
| 外形 | 表面  裏面 裏面  側面 側面  |
|
| 大きさ | 直径 | 6.1mm |
| 厚さ | 3.2mm | |
| 重量 | 110mg | |
| 識別コード | NPC33 | |
4. 効能又は効果
〇月経困難症
〇生殖補助医療における調節卵巣刺激の開始時期の調整
5. 効能又は効果に関連する注意
〈生殖補助医療における調節卵巣刺激の開始時期の調整〉
妊娠率や生産率の報告を踏まえると、本剤を含む低用量卵胞ホルモン・黄体ホルモン配合剤で調節卵巣刺激の開始時期の調整を行った場合は、開始時期の調整を行わない場合と比べて、妊娠率や生産率が低下する可能性があるので、このことを患者に説明した上で、本剤の投与の要否は、患者ごとに治療上の必要性を考慮して慎重に判断すること。[15.1.6参照]
ジェミーナ配合錠電子添文 2023年9月改訂(第4版)
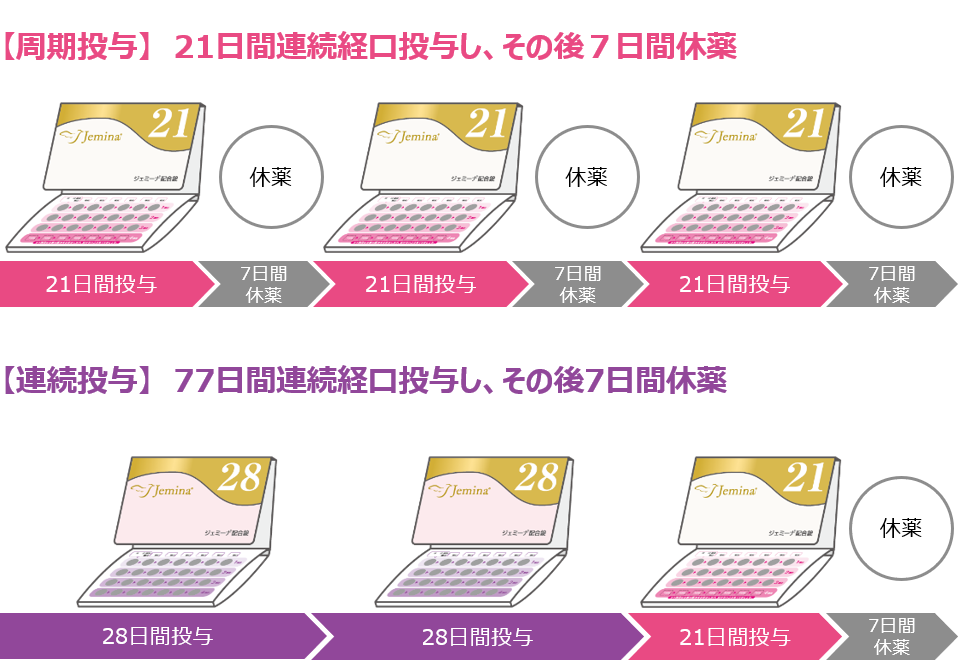
ジェミーナ配合錠は周期投与※と連続投与※※の2通りの投与方法が選択可能な薬剤です。
※周期投与:21日投与7日休薬 ※※連続投与:77日投与7日休薬
6. 用法及び用量
〈月経困難症〉
下記のいずれかを選択する。
- 1日1錠を毎日一定の時刻に21日間連続経口投与し、その後7日間休薬する。以上28日間を1周期とし、出血が終わっているか続いているかにかかわらず、29日目から次の周期を開始し、以後同様に繰り返す。
- 1日1錠を毎日一定の時刻に77日間連続経口投与し、その後7日間休薬する。以上84日間を1周期とし、出血が終わっているか続いているかにかかわらず、85日目から次の周期を開始し、以後同様に繰り返す。
〈生殖補助医療における調節卵巣刺激の開始時期の調整〉
1日1錠を毎日一定の時刻に、通常、14~28日間連続経口投与する。
7. 用法及び用量に関連する注意
〈効能共通〉
- 7.1 毎日一定の時刻に服用させること。
- 7.2 本剤の服用にあたっては飲み忘れ等がないよう服用方法を十分指導すること。
- 7.3 万一前日の飲み忘れに気付いた場合、直ちに前日の飲み忘れた錠剤を服用し、当日の錠剤も通常の服薬時刻に服用する。2日以上服薬を忘れた場合は、気付いた時点で前日分の1錠を服用し、当日の錠剤も通常の服薬時刻に服用し、その後は当初の服薬スケジュールとおり服用を継続すること。
〈月経困難症〉
- 7.4 初めて服用させる場合、原則として月経第1~5日目に服用を開始させること。
● 投与方法
〈月経困難症〉
〈生殖補助医療における調節卵巣刺激の開始時期の調整〉
1日1錠を毎日一定の時刻に、通常、14~28日間連続して服用します。
ジェミーナ配合錠電子添文 2023年9月改訂(第4版)
周期投与※及び連続投与※※、いずれの投与方法においてもプラセボに比べ、月経困難症スコア合計及び月経困難症に対するVAS※※※の有意な減少を示しました。[月経困難症を対象とした国内第Ⅲ相長期投与比較試験(NPC-16-2試験)]試験方法
※周期投与:21日投与7日休薬 ※※連続投与:77日投与7日休薬 ※※※VAS: Visual Analogue Scale
【月経困難症を対象とした国内第Ⅲ相長期投与比較試験(NPC-16-2試験)】
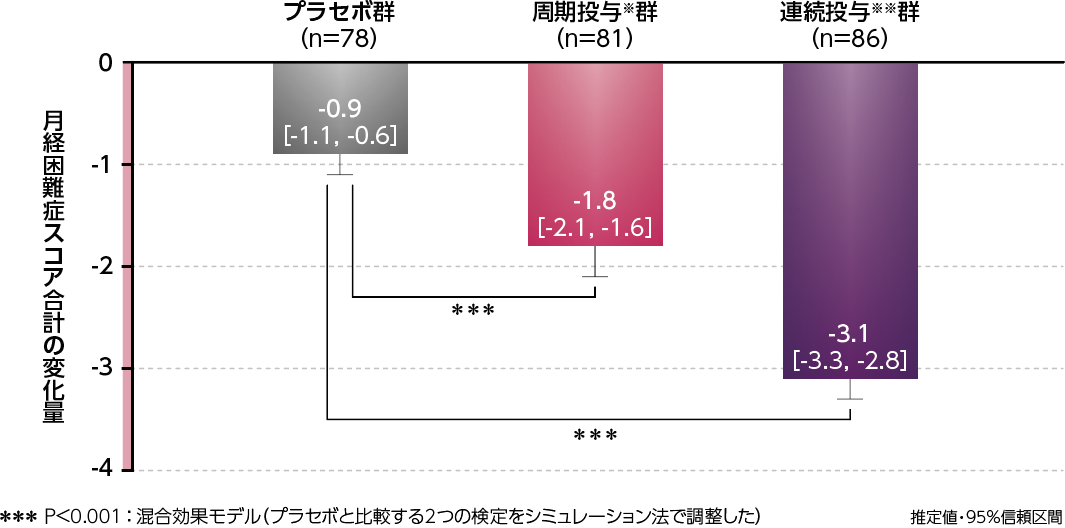
●月経困難症スコア合計の変化量(主要評価項目)
月経困難症スコア合計のベースラインから3周期(1~3周期)までの変化量の推定値は、周期投与※群-1.8、連続投与※※群-3.1であり、プラセボ群の-0.9に対して両群とも有意な減少を認めました(検証的な解析結果)。
- 対象:
- 16歳以上の日本人月経困難症患者248例
- 方法:
- 月経困難症患者に対して、本剤を13周期、プラセボは4周期(1周期:28日)経口投与した。有効性評価項目として、月経困難症スコア合計、月経時以外の骨盤痛スコア合計、Visual Analogue Scale(VAS)、子宮内膜の厚さ、他覚所見を調査した。安全性評価項目として、有害事象、副作用、臨床検査値、子宮の大きさ、性器出血状況、体重、血圧を調査した。
承認時評価資料:第Ⅲ相長期投与試験-無作為化プラセボ対照二重盲検比較試験(NPC-16-2試験)
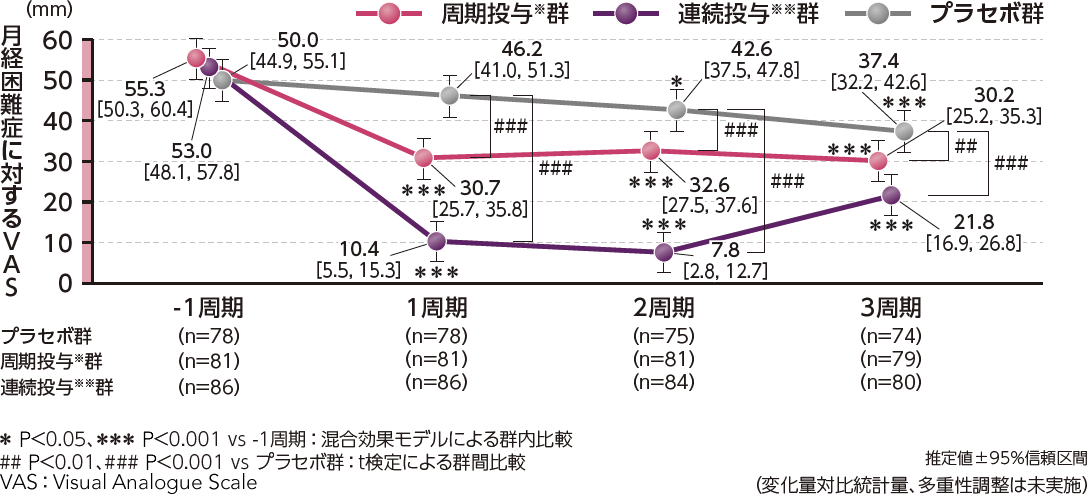
●月経困難症に対するVASの変化量(副次評価項目)
月経困難症に対するVASの変化量について、ベースラインから3周期までの変化量の推定値[95%信頼区間]は、周期投与※群-22.6[-26.4, -18.9](P<0.001、混合効果モデル)、連続投与※※群-39.7[-43.4, -36.0] (P<0.001、混合効果モデル)であり、プラセボ群の-9.5[-13.4,-5.6]に対して両群とも有意な低下を認めました。
- 対象:
- 16歳以上の日本人月経困難症患者248例
- 方法:
- 月経困難症患者に対して、本剤を13周期、プラセボは4周期(1周期:28日)経口投与した。有効性評価項目として、月経困難症スコア合計、月経時以外の骨盤痛スコア合計、Visual Analogue Scale(VAS)、子宮内膜の厚さ、他覚所見を調査した。安全性評価項目として、有害事象、副作用、臨床検査値、子宮の大きさ、性器出血状況、体重、血圧を調査した。
承認時評価資料:第Ⅲ相長期投与試験-無作為化プラセボ対照二重盲検比較試験(NPC-16-2試験)
本剤投与中は経過を十分に観察し、期待する効果が得られない場合には漫然と投与を継続せず、他の適切な治療を考慮してください。
連続投与※※は周期投与※に比べ、月経困難症スコア合計、月経困難症に対するVASのベースラインからの各変化量において有意な減少を示しました。[月経困難症を対象とした国内第Ⅲ相長期投与比較試験(NPC-16-2試験)]試験方法
※周期投与:21日投与7日休薬 ※※連続投与:77日投与7日休薬
【月経困難症を対象とした国内第Ⅲ相長期投与比較試験(NPC-16-2試験)】
●月経困難症スコア合計の変化量
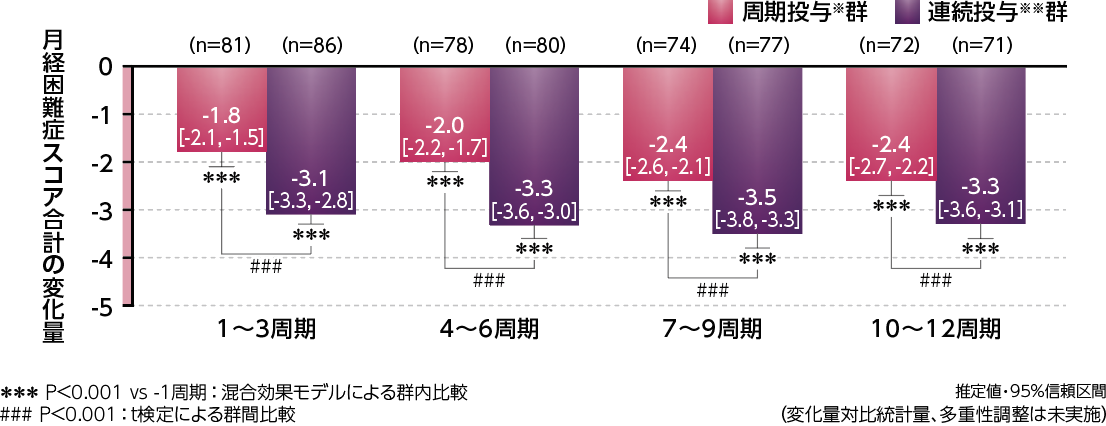
月経困難症スコア合計に対する3周期ごと(1~3、4~6、7~9、10~12周期)のベースライン(-1周期)からの変化量(推定値)は、周期投与※群で-1.8、-2.0、-2.4、-2.4、連続投与※※群で-3.1、-3.3、-3.5、-3.3であり、両群ともベースラインに対して有意な減少を示しました。
また、以下のように周期投与※群と連続投与※※群との比較において、連続投与※※群は3周期ごとのいずれにおいても、周期投与※群より有意な減少を示しました。
- 対象:
- 16歳以上の日本人月経困難症患者248例
- 方法:
- 月経困難症患者に対して、本剤を13周期、プラセボは4周期(1周期:28日)経口投与した。有効性評価項目として、月経困難症スコア合計、月経時以外の骨盤痛スコア合計、Visual Analogue Scale(VAS)、子宮内膜の厚さ、他覚所見を調査した。安全性評価項目として、有害事象、副作用、臨床検査値、子宮の大きさ、性器出血状況、体重、血圧を調査した。
承認時評価資料:第Ⅲ相長期投与試験-無作為化プラセボ対照二重盲検比較試験(NPC-16-2試験)
●月経困難症に対するVASの変化量
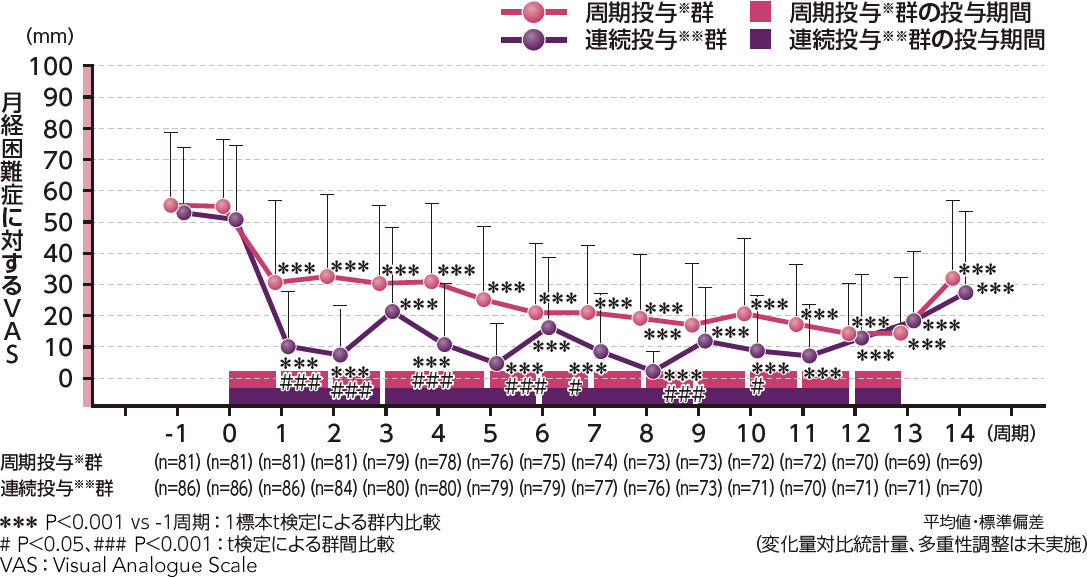
月経困難症に対するVASの3周期ごと(1~3、4~6、7~9、10~12周期)のベースライン(-1周期)からの変化量(推定値[95%信頼区間])は、周期投与※群で-23.4[-27.1, -19.7]、-28.7[-32.4, -24.9]、-35.1[-38.9, -31.4]、-36.4[-40.2, -32.6]、連続投与※※群で-40.6[-44.2, -36.9]、-42.8[-46.5, -39.1]、-46.3[-50.0, -42.6]、-44.3[-48.1, -40.6]であり、両群ともベースラインに対して有意な減少を示しました(P<0.001、混合効果モデル)。
また、周期投与※群と連続投与※※群の群間差は、17.2[12.9, 21.5]、14.1[9.8, 18.5]、11.1[6.7, 15.6]、8.0[3.5, 12.5]であり、連続投与※※群が3周期ごとのいずれにおいても、周期投与※群より有意な減少を示しました(P<0.001、t検定)。
- 対象:
- 16歳以上の日本人月経困難症患者248例
- 方法:
- 月経困難症患者に対して、本剤を13周期、プラセボは4周期(1周期:28日)経口投与した。有効性評価項目として、月経困難症スコア合計、月経時以外の骨盤痛スコア合計、Visual Analogue Scale(VAS)、子宮内膜の厚さ、他覚所見を調査した。安全性評価項目として、有害事象、副作用、臨床検査値、子宮の大きさ、性器出血状況、体重、血圧を調査した。
承認時評価資料:第Ⅲ相長期投与試験-無作為化プラセボ対照二重盲検比較試験(NPC-16-2試験)
本剤投与中は経過を十分に観察し、期待する効果が得られない場合には漫然と投与を継続せず、他の適切な治療を考慮してください。
周期投与※及び連続投与※※、いずれの投与方法においても投与前と比べ、子宮内膜の増殖を抑制することが確認されました。試験方法
※周期投与:21日投与7日休薬 ※※連続投与:77日投与7日休薬
【月経困難症を対象とした国内第Ⅲ相長期投与比較試験(NPC-16-2試験)】
●子宮内膜の厚さの変化量(副次評価項目)
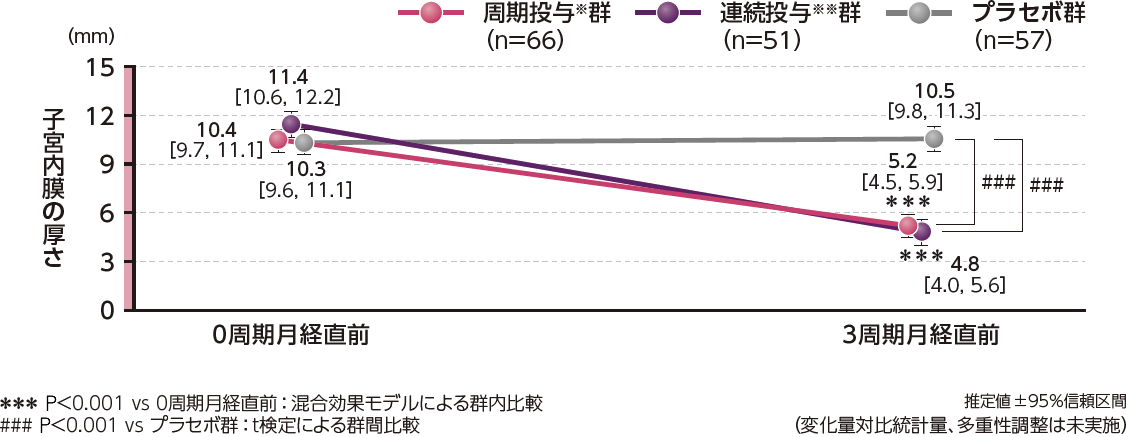
子宮内膜の厚さの変化量について、ベースライン(0周期月経直前)から投与3周期(3周期月経直前)の推定値[95%信頼区間]は、周期投与※群-5.3[-6.0, -4.6](P<0.001、混合効果モデル)、連続投与※※群-6.2[-7.0, -5.4](P<0.001、混合効果モデル)であり、プラセボ群の0.0[-0.8, 0.7]に対して両群とも有意な菲薄化を示しました。
- 対象:
- 16歳以上の日本人月経困難症患者248例
- 方法:
- 月経困難症患者に対して、本剤を13周期、プラセボは4周期(1周期:28日)経口投与した。有効性評価項目として、月経困難症スコア合計、月経時以外の骨盤痛スコア合計、Visual Analogue Scale(VAS)、子宮内膜の厚さ、他覚所見を調査した。安全性評価項目として、有害事象、副作用、臨床検査値、子宮の大きさ、性器出血状況、体重、血圧を調査した。
承認時評価資料:第Ⅲ相長期投与試験-無作為化プラセボ対照二重盲検比較試験(NPC-16-2試験)
本剤投与中は経過を十分に観察し、期待する効果が得られない場合には漫然と投与を継続せず、他の適切な治療を考慮してください。
ジェミーナ配合錠の重大な副作用として血栓症(四肢、肺、心、脳、網膜等)(頻度不明)が挙げられています。主な副作用は不正子宮出血、希発月経、月経過多、下腹部痛、頭痛、悪心、無月経です。詳細は電子添文の副作用及び臨床試験の安全性の結果をご参照ください。
副作用発現率(承認時集計)
●副作用一覧(承認時集計)
月経困難症を対象としてジェミーナ配合錠を13周期にわたって投与した国内第Ⅲ相長期投与比較試験の241症例[周期投与※群82例、連続投与※※群86例、プラセボ群(投与4周期までプラセボを投与し、投与5周期よりジェミーナ配合錠による周期的投与を開始した患者)73例]において、副作用(臨床検査値異常を含む)発現率は88.8%(214例)でした。主な副作用は不正子宮出血187例(77.6%)、希発月経116例(48.1%)、月経過多57例(23.7%)、下腹部痛49例(20.3%)、無月経28例(11.6%)、悪心24例(10.0%)、頭痛20例(8.3%)でした。 投与中止に至った副作用として5例が報告され、周期投与群1例(月経困難症)、連続投与群3例(悪心、倦怠感、不正子宮出血)、投与5周期以降のプラセボ群1例(悪心)でした。本試験において死亡例及び重篤な副作用は認められませんでした。